Katjonbyteskapacitet och basmättnadsgrad
Markpartiklar är elektriskt laddade och kan binda joner från markvätskan. Bindningen är ospecifik – alla joner med motsatt laddning kan binda. De är inte bundna till en viss plats utan är utbytbara och kan byta plats med andra positivt laddade joner.
Katjonbyteskapacitet
Katjoner (+) binds till negativa och anjoner (-) till positiva markladdningar. Markens förmåga att binda katjoner till partikelytor kallas katjonbyteskapacitet (CEC, efter det engelska uttrycket: Cation Exchange Capacity - länk till Wikipedia). För anjoner kallas motsvarande begrepp anjonbyteskapacitet (AEC, efter det engelska uttrycket: Anion Exchange Capacity).
I Sverige har de flesta jordmåner väsentligt högre CEC än AEC. En konsekvens av detta är att katjoner binds bättre i marken än anjoner. Exempel på utbytbara katjoner är kalcium(2+), magnesium(2+), kalium(1+), ammonium(1+), väte(1+), aluminium(3+). Anjoner är t.ex. sulfat(2-), nitrat(1-), klorid(1-) och fosfat(3-). Siffrorna inom parentes anger jonernas laddning.
Mängden joner som binds är beroende av jonladdningen
Enheten för utbyteskapaciteten är cmolc*kg-1 (centimol laddning per kg jord). Ofta anger man dock utbyteskapaciteten i mmolc*kg-1 (d.v.s. millimol laddning per kg jord), eller mekv*kg-1. Mol (länk till Wikipedia) är en SI-enhet för substansmängden. En mol av en substans innehåller ett bestämt antal element (atomer, molekyler). Detta antal är lika med Avogadros konstant d.v.s. ca 6,022*1023. Mängden joner som binds per ytladdning är beroende av jonladdningen. En viss ytladdning kan således binda dubbelt så många kaliumjoner som kalciumjoner därför att kalium förekommer som envärd jon medan kalcium är tvåvärd. Av denna anledning är enheten för utbyteskapacitet angiven som millimol laddning istället för motsvarande mängd joner.
Lermineral och humus avgör markens jonbindningsförmåga
Markens kapacitet att binda joner är framför allt knuten till de små partiklarna, främst lermineral och humus. Humuspartiklar har en stor inre yta där jonutbytesprocesser kan äga rum. Lerrika och humusrika jordar har därför i regel höga värden på CEC och AEC. Jordar som är rika på utfällda järn- och aluminiumoxider har speciellt hög AEC. Organiskt material i humuslagret kan ha CEC runt 1000 mmolc kg-1. Lermineralens CEC varierar mellan 100 och 1500 mmolc kg-1.
Bestämning av katjonbyteskapaciteten
Summeras koncentrationerna (i mmolc kg-1) av de utbytbara baskatjonerna (Ca2+, Mg2+, K+ och Na+) och den totala aciditeten (TA) erhålls provets katjonbyteskapacitet (CEC):
CEC = ∑(Ca2+ + Mg2+ + K+ + Na+ + TA)
Katjonbyteskapaciteten storlek ökar med pH-värdet. Därför kan katjonbyteskapaciteten anges på två olika sätt. I uttrycket ovan har man bestämt halten utbytbara katjoner och totala aciditeten vid pH 7. Det värde på katjonbyteskapaciteten man då får fram kallas ibland potentiell katjonbyteskapacitet eller CECpH7. Katjonbyteskapaciteten vid jordens egentliga pH-värde kallas för effektiv katjonbyteskapacitet (CECeff). Detta CEC-värde kan bestämmas med ett obuffrat extraktionsmedel (exv. NH4Cl) och används ibland när marken har ett pH-värde klart lägre än pH 7. En viss skattning på CECeff kan man få genom att addera de utbytbara baskatjonerna (extraherade med 1N NH4OAc-lösning, buffrad till pH 7.0) med utbytbart aluminium (extraherad med 1 M KCl-lösning):
CECeff = ∑(Ca2+ + Mg2+ + K+ + Na+ + AlKCl)
Basmättnadsgrad
Den totala basmättnadsgraden (bestämd vid pH 7,0) är ett mått på hur stor andel av katjonbyteskapaciteten (CEC) som utgörs av baskatjoner och brukar anges i procent (%):
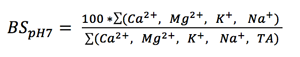
, där Ca2+, Mg2+, K+ och Na+ är utbytbara baskatjoner och TA = total aciditet.
Den effektiva basmättnadsgraden (BSeff,) motsvarar basmättnadsgraden vid jordens pH-värde och beräknas genom följande uttryck:
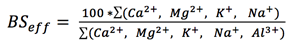
, där Al3+ är utbytbart aluminium bestämt via extraktion med 1 M KCl-lösning.
Även den effektiva basmättnadsgraden (BSeff) brukar anges i procent (%).
Kontakt
-
PersonJohan Stendahl, prefekt och forskareSkogsmarkens biogeokemi